TEORI ATOM
1. Bapak Demokritus dan Aristoteles


Nah, gambar di atas adalah Bapak jenius asal Yunani yang mengemukakan pendapat tentang pengertian atom untuk pertama kalinya, yang paling pertama, sekitar tahun 460-370 tahun SM. (sering orang menyebut Pak Dalton, padahal menurut saya Pak Demokritus lah yang pertama kali mengemukakan pendapatnya).
“trus, apa si pendapat Pak Demokritus ini tentang atom?
Jadi menurut beliau, atom adalah unsur-unsur yang membentuk realitas. Tetapi, unsur-unsur tersebut tidak dapat dibagi-bagi lagi.Karena itulah unsur-unsur tersebut diberi nama atom. Atom berasal dari bahasa Yunani atomos: a berarti tidak dan tomos berarti terbagi.
Tapi ternyata seorang pemikir jenius lainnya, Pak Aristoteles tidak setuju dengan pendapat Demokritus. “Pak, aku kurang setuju dengan pendapat anda”

“Menurut saya suatu zat tersusun atas api, air, tanah, dan udara,”kata pak Aristoteles. Jadi siapa yang lebih tepat? Hal itu pastilah tergantung kepada masyarakat kala itu yang menerimanya. Ternyata teori Pak Aristoteles lah yang lebih banyak diterima dan dijadikan dasar untuk menyusun teori perkembangan berikutnya oleh Pak Dalton.
2. TEORI ATOM DALTON
Selama seribu tahun lebih istilah atom tenggelam, seperti semua orang sudah yakin bahwa apa yang dikatakan Pak Aristoteles adalah kebenaran yang selama ini dicari tentang “tersusun oleh materi apakah suatu zat?”. Tetapi ternyata pada tahun 1803 ada seorang guru SMA di Inggris yang masih penasaran tentang atom. Dengan mendasarkan pada teori Aristoteles, pada sore hari yang cerah, Pak Dalton pun menemukan bukti dan ide-ide mendasar tentang teorinya. Teori ini juga mampu menjelaskan Hukum kekekalan massa Lavoisier dan Hukum perbandingan tetap Proust.

Berikut 5 Teori Atom Dalton:
1. Unsur-unsur terdiri dari partikel-partikel yang luar biasa kecil yang tidak dapat dibagi kembali(disebut atom) berbentuk bola bulat dan masif. Dalam reaksi kimia,mereka tidak dapat diciptakan,dihancurkan atau diubah menjadi jenis unsur yang lain.
2. Semua atom dalam unsur yang sejenis adalah sama dan oleh karena itu memiliki sifat-sifat yang serupa;seperti massa dan ukuran.
5. Atom-atom dari 2 unsur atau lebih dapat direaksikan dalam perbandingan-perbandingan yang berbeda untuk menghasilkan lebih dari 1 jenis senyawa.
Ini dia gambar dari atom menurut pak Dalton: prinsipnya sederhana: bola bulat pejal, massif, tidak memiliki muatan, dan tidak dapat dibagi

Tapi zaman waktu itu sudah berbeda dengan zaman waktu Pak Demokritus, sehingga banyak ilmuwan yang mencoba cara untuk istilahnya mencari “kesalahan” dari teori Pak Dalton. Pak Dalton pun tetap percaya diri. Sebelum ada yang menemukan bukti bahwa teorinya salah, ia menganggap bahwa teorinya adalah yang terbenar.
Ternyata akhirnya memang ada 2 ilmuwan yang kurang setuju dengan Teori Atom Dalton. Mereka adalah Sir Humphry Davy (1778-1892) dan Michael Faraday (1791-1867). Untuk membuktikan bahwa pendapat mereka lebih benar, mereka melakukan eksperimental perubahan kimia ketika arus listrik melewati larutan elektrolit, atau biasa disebut elektrolisis. Begitu menakjubkan, Faraday menemukan bahwa jumlah zat yang dihasilkan di elektroda-elektroda saat elektrolisis sebanding dengan jumlah arus listrik. Pada tahun 1833, Faraday pun menemukan bahwa jumlah listrik yang diperlukan untuk menghasilkan 1 mol zat di elektroda adalah tetap (96,500 C). Hubungan ini disebut sebagai hukum elektrolisis Faraday. Berdasar pendapat temannya seorang ahli kimia, maka Ia menyimpulkan bahwa terdapat satuan dasar dalam elektrolisis, ada analog untuk kelistrikan. Ia pun memberi nama elektron pada satuan hipotetik ini.
Faraday: “Nah, pak Dalton,sekarang bagaimana? Apakah menurut anda listrik bisa mengalir bila atom tak bermuatan? Lalu siapa yang mengendalikan listrik tersebut?”
Sejak saat itu beberapa pernyataan teori atom Dalton pun gugur. Kelemahan Teori atom Dalton. Dalam teori atom dalton tidak dijelaskan dari mana sumber muatan yang ada pada listrik padahal menurut Dalton atom merupakan partikel netral. Kelebihannya adalah Dalton memberikan dasar kepada ilmu kimia tentang apa itu atom.
3. TEORI ATOM THOMSON

Setelah teori atom Dalton dinyatakan gugur karena ada pertanyaan yang belum bisa dijawab olehnya, maka Pak Thomson pun pada sekitar tahun 1890-an mencoba melakukan percobaan untuk mencari jalan keluar masalah tersebut. Dengan berdasar teori ilmuwan lainnya seperti Sir Humphry Davy yang membuktikan bahwa gas menjadi penghantar listrik yang lebih baik pada tekanan rendah, Thomson pun melakukan percobaan menggunakan tabung sinar katoda. Jadi tabung di bawah ini adalah tabung hampa udara, dan di masing-masing ujung tabung diberi

arus listrik dengan tegangan yang cukup tinggi, ternyata pada tekanan yang rendah dan suhu tinggi, gas dalam tabung akan berpijar tergantung jenis zat dalam tabung. Jika tekanan gas dikurangi, daerah depan katode akan menjadi gelap. Daerah gelap ini terus bertambah jika tekanan gas terus dikurangi. Akhirnya, seluruh tabung menjadi gelap, tetapi bagian tabung depan katode berpendar dengan warna kehijauan. Melalui percobaan, dapat dibuktikan bahwa warna kehijauan itu adalah radiasi partikel. Karena berasal dari katode, maka sinar itu dinamakan sinar katode.
Percobaan lebih lanjut membuktikan bahwa sinar katode merupakan radiasi partikel yang bermuatan listrik negatif yang selanjutnya disebut elektron.
1. Sinar katode merambat lurus dari permukaan anode menuju katode
2. Sinar katode dapat memutar kincir
3. Sinar katode dibelokkan kea rah kutub positif
"Atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar muatan negatif elektron" inilah kesimpulan teori dari pak Thomson.

Kelebihan
Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur.
Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur.
Kelemahan
Model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut, belum dapat menjelaskan reaksi kimia yang terjadi antar atom
Model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut, belum dapat menjelaskan reaksi kimia yang terjadi antar atom
4. Teori Atom Rutherford

Setelah Pak Thomson mengemukakan teorinya, pada tahun 1910 Pak Rutherford pun tak kalah melakukan percobaan untuk mengungkapkan teori versi miliknya. Dengan dibantu oleh dua orang muridnya, mereka melakukan percobaan yang dikenal dengan hamburan sinar alfa, yaitu partikel yang bermuatan positif, dan bergerak lurus, berdaya tembus besar sehingga dapat menembus lembaran tipis kertas.


Percobaan tersebut sebenarnya bertujuan untuk menguji pendapat Thomson, yakni apakah atom itu betul-betul merupakan bola pejal yang positif yang bila dikenai partikel alfa akan dipantulkan atau dibelokkan. Dari pengamatan mereka, didapatkan fakta bahwa apabila partikel alfa ditembakkan pada lempeng emas yang sangat tipis, maka sebagian besar partikel alfa diteruskan (ada penyimpangan sudut kurang dari 1°), tetapi dari pengamatan Marsden diperoleh fakta bahwa satu diantara 20.000 partikel alfa akan membelok sudut 90° bahkan lebih, atau ada yang dipantulkan. Hal ini pastialh tidak sesuai dengan teori Thomson dimana atom digambarkan bersifat homogen yang padat pada semua bagiannya.Nah, pasti ada sesuatu khan disana?
Berdasarkan percobaan jeniusnya itulah Rutherford mengemukakan gagasannya tentang inti atom. Menurutnya, sebagian besar massa dan muatan positif atom terkonsentrasi pada bagian pusat atom yang selanjutnya disebut inti atom.Elektron beredar mengitari pada jarak yg relative sangat jauh. Jarak antara inti hingga kulit atom dinamakan jari-jari atom.
Dengan model seperti itu, maka penghamburan sinar alfa lempeng emas tipis dapat dijelaskan sbg berikut:
1. Sebagian besar partikel sinar alfa dapat tembus karena melalui daerah hampa
2. Partikel alfa yang mendekati inti atom dibelokkan karena mengalani gaya tolak inti
3. Partikel alfa yang menuju inti atom dipantulkan karena inti bermuatan positif dan sangat pejal
“Atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif. “ jadi inilah kesimpulan bagaimana bentuk atom meurut Rutherford.
Kelebihan:
Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti
Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti
Kelemahan:
Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lama - kelamaan energi elektron akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti Ambilah seutas tali dan salah satu ujungnya Anda ikatkan sepotong kayu sedangkan ujung yang lain Anda pegang. Putarkan tali tersebut di atas kepala Anda. Apa yang terjadi? Benar. Lama kelamaan putarannya akan pelan dan akan mengenai kepala Anda karena putarannya lemah dan Anda pegal memegang tali tersebut. Karena Rutherford adalah telah dikenalkan lintasan/kedudukan elektron yang nanti disebut dengan kulit
Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lama - kelamaan energi elektron akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti Ambilah seutas tali dan salah satu ujungnya Anda ikatkan sepotong kayu sedangkan ujung yang lain Anda pegang. Putarkan tali tersebut di atas kepala Anda. Apa yang terjadi? Benar. Lama kelamaan putarannya akan pelan dan akan mengenai kepala Anda karena putarannya lemah dan Anda pegal memegang tali tersebut. Karena Rutherford adalah telah dikenalkan lintasan/kedudukan elektron yang nanti disebut dengan kulit
4. Teori atom Niels Bohr

Ternyata benar segala sesuatu yang ada di dunia ini tidak ada yang sempurna. Setiap teori yang dikeluarkan ilmuwan pasti disamping ada kelebihannya, juga ada kekurangannya. Dengan percobaannya, tahin 1911, Niels Bohr berusaha memperbaiki teori Rutherford dengan melakukan percobaan spectrum atom hydrogen.
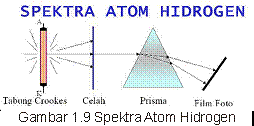
Lalu dari percobaan tersebut, gimana si teori atom Pak Niehl Bohr ni?
1. Menurutnya, Hanya ada seperangkat orbit tertentu yang diperbolehkan bagi satu elektron dalam atom hidrogen. Orbit ini dikenal sebagai keadaan gerak stasioner (menetap) elektron dan merupakan lintasan melingkar disekeliling inti.
2. Selama elektron berada dalam lintasan stasioner, energi elektron tetap sehingga tidak ada energi dalam bentuk radiasi yang dipancarkan maupun diserap.
3. Elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lain. Pada peralihan ini, sejumlah energi tertentu terlibat, besarnya sesuai dengan persamaan planck, ΔE = hv
4. Lintasan stasioner yang dibolehkan memilki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut. Besarnya momentum sudut merupakan kelipatan dari h/2∏ atau nh/2∏, dengan n adalah bilangan bulat dan h tetapan planck
2. Selama elektron berada dalam lintasan stasioner, energi elektron tetap sehingga tidak ada energi dalam bentuk radiasi yang dipancarkan maupun diserap.
3. Elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lain. Pada peralihan ini, sejumlah energi tertentu terlibat, besarnya sesuai dengan persamaan planck, ΔE = hv
4. Lintasan stasioner yang dibolehkan memilki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut. Besarnya momentum sudut merupakan kelipatan dari h/2∏ atau nh/2∏, dengan n adalah bilangan bulat dan h tetapan planck
Jadi menurut pak bohr, electron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut kulit electron atau tingkat energi.tingkat energy paling rendah adalah kulit electron yang terletak paling dalam.semakin keluar semakin besar nomor kulitnya dan semakin tinggi tingkat energinya.


Kelebihan
atom Bohr adalah bahwa atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan
model atom ini adalah tidak dapat menjelaskan efek Zeeman dan efek Strack
atom Bohr adalah bahwa atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan
model atom ini adalah tidak dapat menjelaskan efek Zeeman dan efek Strack
5. TEORI ATOM MEKANIKA KUANTUM atau MEKANIKA GELOMBANG

Setelah teori Niehl Bohr ternyata juga mempunyai kelemahan, ilmuwan berikutnya yang berusaha memperbaiki adalah Erwin Schrodinger. Berdasar pengembangan selanjutnya yang mengatakan bahwa lintasan electron itu tidak berbentuk bulat mengelilingi inti namun menyerupai gelombang. Oleh karena itu, posisinya tidak dapat diketahui secara pasti. Teori atom mekanika kuantum memiliki persamaan dengan teori Niels bohr mengenai tingkat-tingkat energy atau kulit atom, tetapi berbeda dalam hal lintasan atau orbit tersebut.
Percobaan yang dilakukannya adalah percobaan Chadwick


Kesimpulan hasil percobaan:

Awan elektron disekitar inti menunjukan tempat kebolehjadian elektron. Orbital menggambarkan tingkat energi elektron. Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk sub kulit. Beberapa sub kulit bergabung membentuk kulit.Dengan demikian kulit terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital. Walaupun posisi kulitnya sama tetapi posisi orbitalnya belum tentu sama.
Kelemahan Model Atom Modern
Persamaan gelombang Schrodinger hanya dapat diterapkan secara eksak untuk partikel dalam kotak dan atom dengan elektron tunggal.
Thanks a lot :)
BalasHapusJadi bisa ngerjain tugas nih..
Ya okeh sama-sama.
Hapusmakasih atas materinya.............
BalasHapusakhirnya pr aku selesai !
Yah oke sama-sama. Nih peer kuliah aku juga waktu smt 1 eheheh
HapusTHX dhh tugas skolah langsung beres gra2 ini
BalasHapusYoi bro sama-sama.
HapusThanks akhirnya tugas tersulitku telah selesai
BalasHapusHehe, okeh bro.
Hapussebenernya sy nemu banyak refrensi terkait materi ini, tapi apa yg kamu tulis disini unik... sy suka bahasanya.. easy learning gitu.. makasih..
BalasHapusnb : semoga mimpinya diijabah.. sy juga dari sleman.. ^^
Makasih broh, salam kenal =)
Hapusamiiinnn...kamu juga semoga mimpinya (apapun itu) dijabah.
mau tanya ,, kalo di model atom-nya pak Thomson kok ngga menghasilkan kesimpulan sebaliknya ya? kok ngga atom adalah 'bola pejal yang bermuatan negatif' tapi malah bola pejal yang bermuatan positif? mohon bantuannya ,,, makasi :)
BalasHapus